
以下文章来源于至境程 ,作者至境程
2024年5月11日,国家药监局组织修订发布了《体外诊断试剂分类目录》(以下简称《分类目录(2024版)》)。在沿用原有《6840体外诊断试剂分类子目录(2013版)》(以下简称6048)和《关于发布〈体外诊断试剂分类规则〉的公告》(国家药品监督管理局公告2021第129号,(以下简称《分类目录(2021版)》)的基础上,做出了较大的调整【1-3】。
我整理了24版《分类目录》的变化,并就个人的理解,分享我所理解的政策所指向的未来趋势和将受政策影响较大的一些细分行业。个人理解存在较大局限性,仅供参考(蓝色字体均为个人观点)。
一、新版结构调整:新增一二级分类
《分类目录》结构由2013版的五项,调整为六项,“一级序号、一级产品类别、二级序号、二级产品类别、预期用途、管理类别”六个部分。请见图1 《分类目录(2024版)》与6048的对比。
《6048体外诊断试剂分类子目录(2013版)》
《分类目录(2024版)》
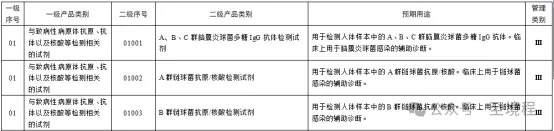
图1 《分类目录(2024版)》与6048的对比
目录按照管理类别由高到低的顺序进行排序:一级目录01-07为第三类体外诊断试剂,共计7个;08-19为第二类体外诊断试剂,共计12个,20-25为第一类体外诊断试剂,共计5个。
第二、三类分类上依据《分类目录(2021版)》设立的分类并维持不变。
二、一级分类增加三个
第一类体外诊断试剂从原有3个,增加到5个,分别为:
1)仅提供辅助诊断信息的流式细胞仪用单一抗体试剂及同型对照抗体(一级目录序号23,共62个)
2)仅提供辅助诊断信息的免疫组化用单一抗体试剂(一级目录序号24,共438个)
3) 仅提供辅助诊断信息的原位杂交用单一探针试剂(一级目录序号25,共122个)
并且在17号文第九条中,特别强调了只有流式细胞仪用、免疫组化、原位杂交产品涉及“单一抗体”或“单一探针”可以按照第一类管理。第一类的“单一抗体”或“单一探针”组合后,作为第二类或第三类管理。
《分类目录》中未包含的组合产品,如组合后的预期用途仅为单项产品预期用途的组合,应当按照所包含的单项产品的最高管理类别确定其管理类别。如有新增预期用途,应当按照相关要求申请分类界定。
(1)双染及多染产品作为第二类或第三类管理
这说明随着多色免疫荧光染色,免疫组化双染、多染及多色荧光原位杂交等技术的发展,监管部门应该是已经注意到了,由于各省分类界定缺乏统一标准,导致有一些免疫组化厂家按照一类管理备案形式已经拿到了免疫组化双染、三染的备案证;而一些省份的双染、三染产品通过省局上报国家局申请分类界定,被界定为二类或三类。24版的分类新规意味着已有拿一类证的双染、三染产品从2027年1月1日起全部要按照作为第二类或第三类管理。
这个界定标准,可能是从风险性上考虑的。从技术角度,多探针、多抗体在同一试剂盒中进行不同靶点检测,可能存在信号之间互相干扰的问题,对试剂的阻断剂,显色剂,抗体的种属性、特异性有着较高要求,对试剂的灵敏度、特异性等性能指标有着较高要求,是需要提供临床数据与现有单染产品进行对比验证的。
(2)以“微珠”或者“微球”为载体的检测试剂至少按照第二类管理,将加强对细胞治疗相关检测的管理力度
24版的新规中明确:通过捕获体液中其他成分形成生物粒子、从而用流式细胞仪进行检测的体外诊断试剂,不符合《分类规则》中“流式细胞仪用单一抗体”有关要求,如在流式平台上,基于抗原抗体反应,以特定“微珠”或者“微球”为载体,对白介素、干扰素、肿瘤坏死因子等物质进行检测分析的试剂。该界定逻辑遵循了“只有‘单一抗体’或‘单一探针’可以按照第一类管理”的逻辑。
在流式检测中使用“微珠”或“微球”,“微珠”或者“微球”磁珠的粒径、表面积大小及其均匀程度都将影响其检测性能和可重复性,磁珠与抗体的偶联工艺及抗原、抗体质量更是影响磁珠捕获效率的关键因素。
为什么强调是对白介素、干扰素、肿瘤坏死因子的检测?
白介素、干扰素、肿瘤坏死因子的检测固然与多种疾病的诊断、预后、疗效相关。但什么特别强调此三种细胞因子使用磁珠的检测至少要按第二类以上管理?
另外,12个流式细胞仪配套用产品由一类升为二类管理,具体包括:α-干扰素检测试剂、γ-干扰素检测试剂、白介素-1β检测试剂、白介素2检测试剂、白介素4检测试剂、白介素5检测试剂、白介素6检测试剂、白介素8检测试剂、白介素10检测试剂、白介素17检测试剂、白介素12p70检测试剂、肿瘤坏死因子α检测试剂。
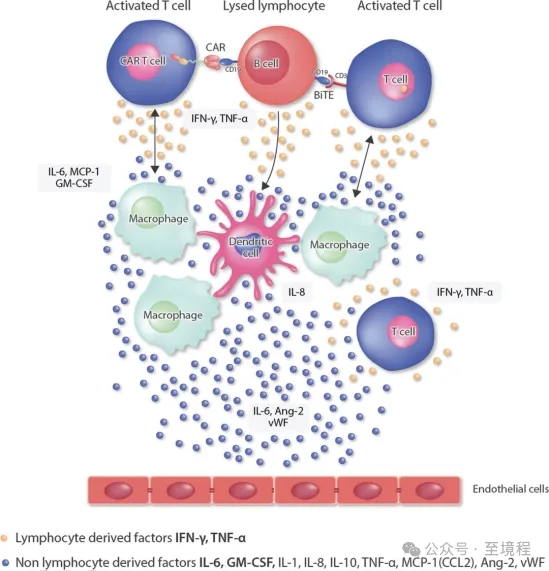
图2 CRS的发生机制【4】
熟悉细胞治疗行业的人,对细胞因子释放综合征(CRS)肯定不陌生。CRS是CAR-T治疗后最常见的严重不良反应。CAR-T细胞疗法输注患者体内后,诱导IFN-γ或TNF-a的释放,巨噬细胞和内皮细胞产生大量IL-6,而IL-6以正反馈的方式激活T细胞和其他免疫细胞,导致CRS的发生,引起全身炎症反应以及组织器官的严重损伤。在CAR-T输注及预处理过程中,监测IFN-γ、TNF-α、IL-6、IL-8和GM-CSF等细胞因子的水平和变化,有利于CAR-T治疗后CRS的早期诊断,及时干预和疗效监测。
提高此三种细胞因子使用磁珠的检测的管理级别,有利于杜绝一些细胞治疗厂家,在开展CAR-T细胞治疗临床实验时,以一类备案证形式将相应的检测试剂盒入院,向临床入组病人收取入组前的检测费用,或将检测费用纳入医保范围增加医保负担。
三、24版对预期用途描述更为详细,根据临床用途划分类别
“预期用途”涉及的内容比6048更为详细,包括被测物及主要临床用途等。
个人觉得是强调了主要临床用途,使用此表格查询时更为方便,可以根据临床用途和涉及的临床疾病名称,在表格中进行搜索查询。
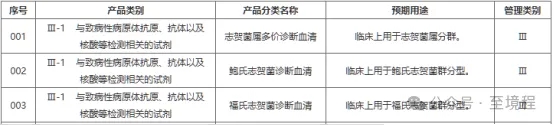
图3中列出的相同被测物依据用途不同管理级别不同的对比表格可以看出,低类别条目的预期用途描述中,都明确写了“不用于”高类别管理的预期用途。强调的内容,意味以后在举报和监管“低级别产品违规涉高级别用途操作”时有据可循,未来的监管力度会加强。
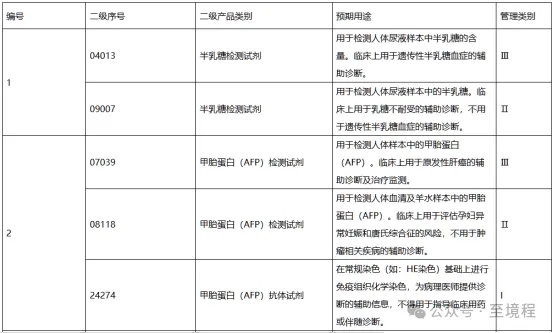
图3 相同被测物依据用途不同管理级别不同
四、24版增加二级序号,查询更为简便
二级序号为每一个产品类别的唯一编码,编码规则为从左到右第一、二位是“一级类别序号”,后三位是在该一级类别中的序号。不同的“一级类别序号”都从后三位“001”开始计数。也就是说每个类别中最后一个只要看它的编码,就知道该类别有多少个产品了,使用起来非常简便。
例如:下图中第三列的5为数字,一看就是为一级目录中第25个。它又是最后一个产品的编码,所以25类产品“仅提供辅助诊断信息的原位杂交用单一探针试剂”共计有122个。

五、对培养基的分类,将影响细胞治疗和肿瘤类器官药敏检测
明确了仅基础培养基产品可按照第一类管理的细胞培养基,如RPMI-1640 培养基,并根据《分类规则》明确用途限制(不用于细胞治疗、细胞回输、辅助生殖等非体外诊断用途)。
括弧里面的内容是关键。随着肿瘤类器官技术的发展,各种专家共识和行业标准的推出,基于肿瘤类器官培养基的分类界定已经在24年被国家局界定为三类。
这次重申对于已备案的明确所培养的细胞类型、细胞来源,但不能明确其预期用途的细胞培养基产品,不列入《分类目录》,如上皮细胞培养基、肿瘤细胞培养基、结直肠细胞培养基、肝细胞培养基、骨髓细胞培养基等。相关产品应当明确预期用途后申请分类界定,依据用途界定管理级别,以后会是总原则。
【引用文献】
【1】国家药监局关于实施《体外诊断试剂分类目录》有关事项的通告(2024年第17号)https://www.nmpa.gov.cn/xxgk/ggtg/ylqxggtg/ylqxqtggtg/20240511171642107.html
【2】国家药监局关于发布体外诊断试剂分类目录的公告(2024年第58号)
https://www.nmpa.gov.cn/xxgk/ggtg/ylqxggtg/ylqxqtggtg/20240511172028171.html
【3】国家药监局关于规范医疗器械产品分类界定工作的公告(2024年第59号)
https://www.nmpa.gov.cn/xxgk/ggtg/ylqxggtg/ylqxqtggtg/20240511175941109.html
【4】Jorge Garcia Borrega,Philipp Gödel,Maria Adele Rüger, et al. In the Eye of the Storm: Immune-mediated Toxicities Associated With CAR-T Cell Therapy. HemaSphere. 2019;3 (2):e191-e191. doi:10.1097/hs9.0000000000000191.



